
技术文章
Technical articles 热门搜索:
Sybr Gold核酸染料
转染试剂(Lipo3000)
M1050-10mlMBP标签亲和填料 (麦芽糖结合蛋白)
500bp DNA Marker
(N30210-1L)Ni NTA Beads 6FF(镍填料)
P0105一步法SDS-PAGE AB液快速制胶试剂盒10%
P10310预染蛋白Marker 10-310KD
M1050-100mlMBP标签亲和填料 (麦芽糖结合蛋白)
DNA Assembly Mix Plus无缝克隆
Y0003-250g(50g/L)YPDPlus培养基
P1025预染蛋白Marker(10-250KD)
Ni NTA Beads 6FF(镍填料)
M0500-500ml膜再生液
P1018-预染蛋白Marker 10-180KD
金担子素A
1kb Plus DNA Marker
热门搜索:
Sybr Gold核酸染料
转染试剂(Lipo3000)
M1050-10mlMBP标签亲和填料 (麦芽糖结合蛋白)
500bp DNA Marker
(N30210-1L)Ni NTA Beads 6FF(镍填料)
P0105一步法SDS-PAGE AB液快速制胶试剂盒10%
P10310预染蛋白Marker 10-310KD
M1050-100mlMBP标签亲和填料 (麦芽糖结合蛋白)
DNA Assembly Mix Plus无缝克隆
Y0003-250g(50g/L)YPDPlus培养基
P1025预染蛋白Marker(10-250KD)
Ni NTA Beads 6FF(镍填料)
M0500-500ml膜再生液
P1018-预染蛋白Marker 10-180KD
金担子素A
1kb Plus DNA Marker
 更新时间:2025-09-19
更新时间:2025-09-19 点击次数:1320
点击次数:1320
WB 实验即蛋白质印迹法,是分子生物学、生物化学等领域常用的实验技术。它依据抗原抗体的特异性结合原理,能对样品中的特定蛋白质进行定性或半定量分析。WB 实验凭借高特异性和灵敏度,在蛋白质表达水平研究、蛋白质分子大小鉴定、疾病标志物检测等方面发挥着重要作用,是生命科学研究中不ke或缺的有力工具。
实验原理

WB实验基于抗原-抗体的特异性结合反应,通过聚丙烯酰胺凝胶电泳分离蛋白质,将其转移至固相载体(如PVDF膜),再利用特异性一抗和酶标记二抗进行检测,最终通过化学发光或显色反应实现目标蛋白的定性、定位及半定量分析。
实验步骤
一、样本制备
1.样本收集
①贴壁细胞收集:吸出培养基,向培养皿中加入预冷的1×PBS,漂洗2次,利用细胞刮或胰酶消化收集贴壁细胞,细胞转移到离心管,离心收集细胞沉淀。
②悬浮细胞收集:先离心收集细胞沉淀,再用预冷 PBS 轻轻吹打重悬,然后离心收集细胞沉淀。
③动物组织样本收集:在冰上用干净的医用剪将组织剪成小块。然后在液氮中将组织研磨粉碎。
④植物样本收集:取适量植物组织样本(叶片等)放置于冷冻液氮中,之后将冷冻后的植物组织放于研钵进行研磨,尽可能充分研磨破坏其细胞壁。
2.总蛋白提取
①细胞/组织裂解:
细胞样本,加入预冷的裂解缓冲液(含有 PMSF/蛋白酶抑制剂),冰上裂解 15min。
组织样本,按照 1mL 裂解液/100mg 组织向匀浆器中加入蛋白裂解液,多次匀浆,直至组织完quan匀浆,收集匀浆液。
②把裂解好的样本12000rpm离心10min,取上清用于后续实验。
③蛋白变性:
吸取 10μl 蛋白上清做蛋白浓度(BCA 法)测定。向剩余的蛋白提取液中加 5× Loading Buffer(最终工作液为 1x),95℃加热变性 10min,待液体完quan冷却后置于-20℃分装保存,避免反复冻融。
相关产品:

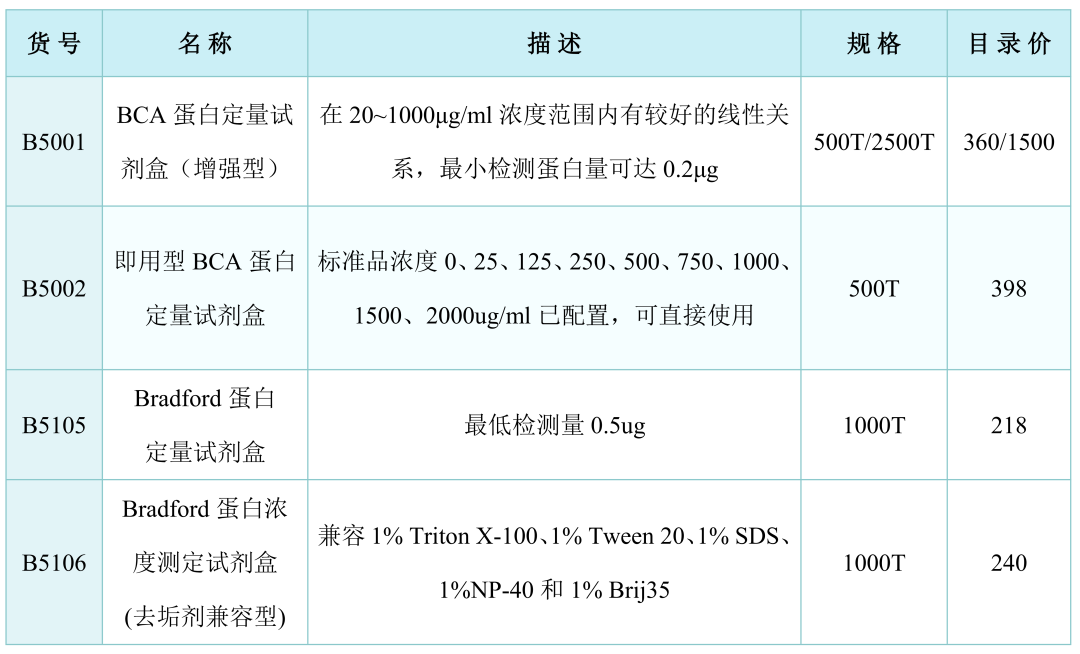
二、蛋白浓度测定
1.BCA法
测定原理:在碱性环境下蛋白质与Cu2+络合并将Cu2+还原成Cu+。BCA与Cu+结合形成稳定的紫蓝色复合物,在562 nm处有高的光吸收值并与蛋白质浓度成正比,据此可测定蛋白质浓度。
特点:灵敏度高,操作简单,试剂及其形成的紫蓝色复合物稳定性俱佳,并且受干扰物质影响小,不受去垢剂的影响。
2.Bradford法
测定原理:在酸性条件下考马斯亮蓝(Coomassie brilliant blue G-250)与蛋白质结合后,染料的最大吸收峰由465nm变为595nm,溶液的颜色由棕色变为蓝色,形成的复合物颜色的深浅与蛋白浓度的高低成正比关系,因此可以在595 nm波长下测定吸光度值从而计算蛋白含量。
特点:操作简单,对EDTA、EGTA等还原剂兼容性好,但易受强碱性和高浓度去污剂影响。
3.Lowry法
测定原理:碱性条件下,蛋白质与铜作用生成蛋白质-铜络合物此络合物将Folin试剂还原,产生深蓝色,颜色深浅与蛋白质含量成正比。
特点:不受脂类物质干扰,也能耐受相当浓度的去垢剂如SDS。
相关产品:
三、凝胶电泳
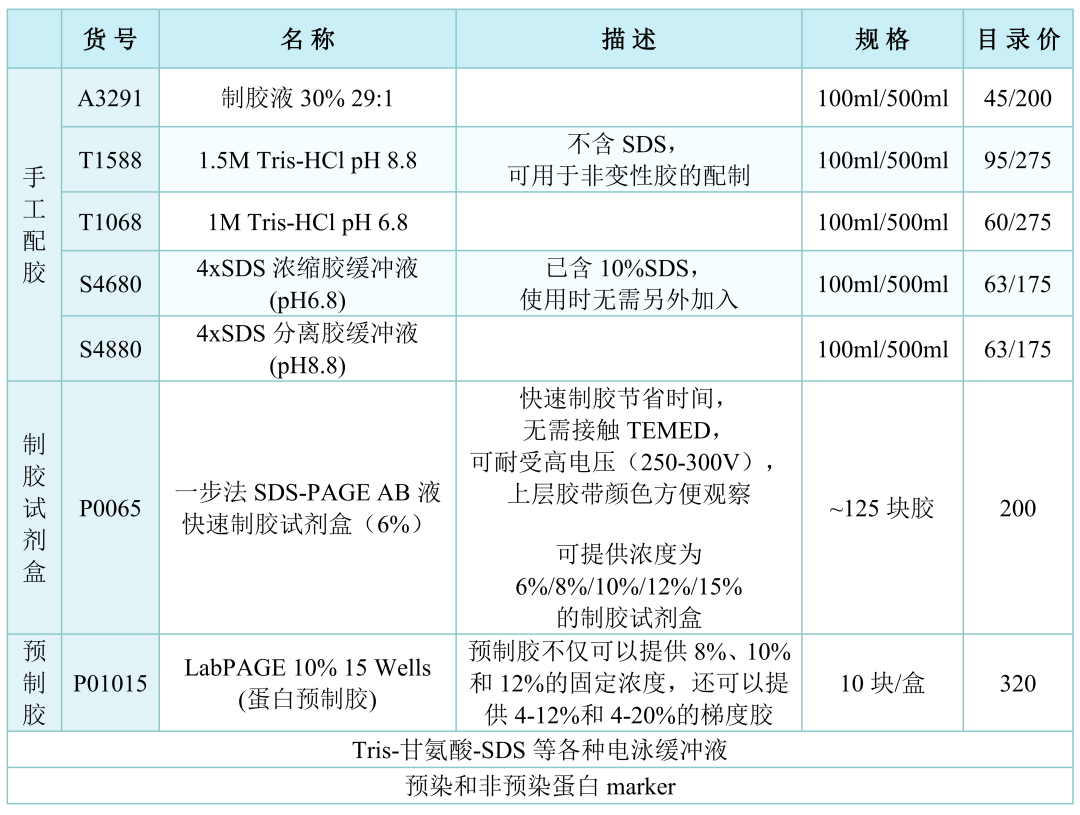
1.制胶
①取干净的胶板,用水冲洗后,擦拭干净,对齐插入板夹中。
②检漏:加入水检查是否漏水(20min),将水倒掉,用吸水纸吸干净。
③配分离胶:取干净的空烧杯,按照下层胶配比(分离胶)依次加入、混匀。加TEMED之后混合均匀,迅速加入两板之间,液体加至距短板上约2cm处停止加液。用异丙醇进行液封,室温放置待下层胶凝固(20min),倒掉上层液体,吸水纸吸干水。
④配浓缩胶:按比例配制浓缩胶,加速混匀,迅速加入两板之间。插入梳子,室温放置,待上层胶凝固(20min)。从固定台上取下夹板,打开夹子。
注:除了添加各种试剂手工配胶,目前还有制胶试剂盒和预制胶的两种更加方便快速的制胶方法。
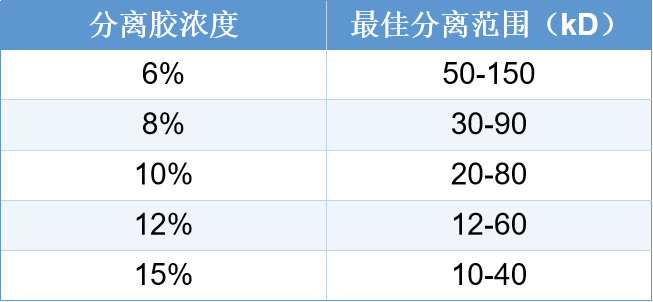
浓缩胶浓度选择:
2.跑胶
①将胶板上的梳子拔出后,在流水中轻柔冲洗上样孔,将碎胶冲出孔外。
②将胶板组装在电泳仪器上,注意短的玻璃板朝电泳槽内放置,要对齐夹紧不能漏液。
③加入电泳液,内槽必须加满电泳缓冲液,外槽可以不加满。
注:注意观察内槽是否漏液,若漏液的话需要重新装板。
④按照方案将蛋白和marker加入上样孔中,目的蛋白每孔上样量20μg-40μg,内参蛋白每孔上样量5μg-10μg。marker的用量参考试剂说明书。
⑤盖上盖子,注意不要弄错方向,连接电源;浓缩胶设置恒压80V,跑胶30min左右,然后设置分离胶恒压120V,至溴酚蓝到达胶的底端处附近即可停止电泳。
注:不同的胶跑胶时间可能会有区别,主要以第一次实验建议多观察几次,记录跑胶所需要的时间。
相关产品:
四、转膜
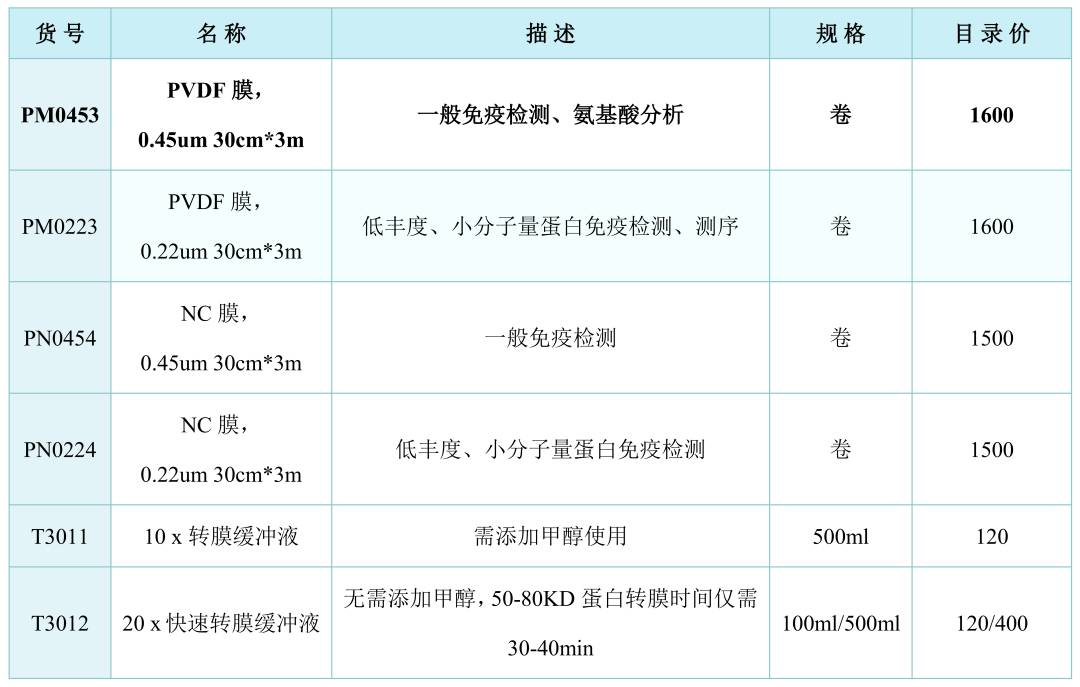
1. 将PVDF膜浸泡在甲醇中激活30s。
注:PVDF膜有0.22μm和0.45μm两种规格的,20KD以下蛋白建议选用0.22μm的,20KD以上蛋白建议选用0.45μm的。
2. 电泳结束后将胶板取出,短玻璃板朝上放置,揭开短玻璃板后切除多余的胶,在水中将胶从长玻璃板上取下。
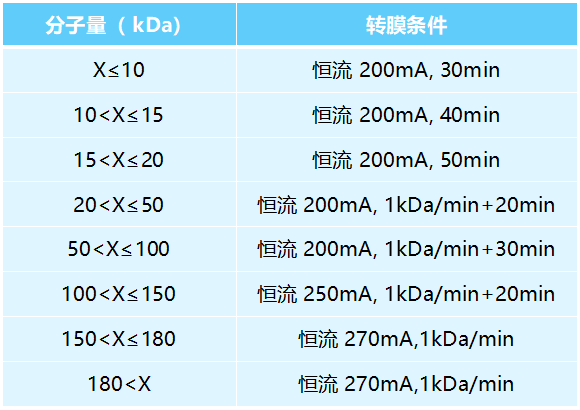
3. 在电转液中,转膜夹黑色面朝下,依次放置海绵-滤纸-胶-PVDF膜-滤纸-海绵(三明治结构),夹紧转膜夹,PVDF膜要与胶贴合,排走气泡。调整转膜夹黑色界面转向转膜槽负极,白色面朝向转膜槽正极。灌满转膜液后,用200-400mA恒定电流转膜,转膜要在冰浴中进行。
注:转膜的时间和蛋白大小、电流大小及转膜液的类型有关。
转膜条件选择:
相关产品:
五、封闭
1. 将膜取出后,应观察到marker完quan从胶转移至膜上。
2. 用TBST清洗掉膜上残留的转膜液,每次5-10分钟,洗3-5次。
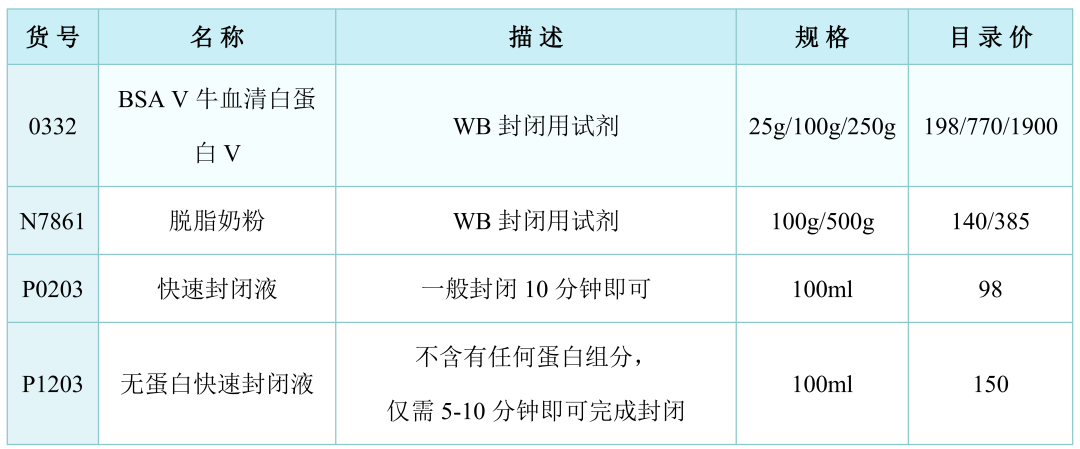
3. 将PVDF膜浸泡在5% 脱脂牛奶中,缓慢摇荡,室温孵育1h。
注:除脱脂牛奶,封闭也可以用BSA或者商品化的封闭液。
相关产品:
六、抗体孵育
1. 孵育一抗:封闭结束后,用1xTBST缓冲液洗掉多余封闭液,洗膜每次5-10min,共3-5次。一抗使用一抗稀释液或TBST按照抗体说明书建议的比例稀释(具体条件自行摸索)使用,然后将膜浸泡在一抗中,于4℃冰箱中摇床孵育过夜,一抗孵育后可以回收。
2. 孵育二抗:用1xTBST缓冲液洗掉多余一抗,洗膜每次5-10min,洗3-5次。使用5%脱脂牛奶或商品化抗体稀释液按照说明书推荐比例稀释二抗,室温慢摇1h。
3. 洗膜:二抗孵育完毕后,回收二抗,用1xTBST洗膜,每次5-10min,洗3-5次。
相关产品:

七、曝光
1. 配置显影液(A液:B液=1:1),避光。
2. 显影液滴于PVDF膜上,孵育1-3min。
3. 孵育结束后,垂直吸取多余发光液,蛋白面朝上置于仪器中,可裁剪锡箔纸遮光。
相关产品:
